La microscopie multi-photon au service des maladies
- Pour comprendre les mécanismes et les processus physiologiques fondamentaux comme ceux de plusieurs pathologies, il est primordial d’observer l’activité métabolique cellulaire en temps réel avec une résolution subcellulaire.
- En Biologie, il est courant de « taguer » des molécules avec des marqueurs de fluorescence, mais cela est une technique invasive, car on doit « rentrer » dans la cellule.
- Cependant, il existe des molécules fluorescentes déjà présentes dans les cellules, que l’on peut stimuler, sans pour autant les intégrer artificiellement et interférer avec le système vivant.
- Acquérir ce type de connaissance ouvre la voie à de nombreuses applications en médecine, car cela permet de cartographier le métabolisme des cellules — indicateur de leur activité. Ce qui, par exemple, permet l’identification du métabolisme de cellules cancéreuses, susceptibles de développer de nombreuses formes de cancers.
Chiara Stringari, chercheuse au Laboratoire d’optique et de biosciences de l’École polytechnique (LOB), joue à la frontière de différentes disciplines scientifiques. Son but : développer des techniques innovantes d’observation microscopique permettant de cartographier l’activité métabolique des cellules et des tissus avec plus de précision. Pour cela, elle emploie une technique qui se base sur la microscopie optique à deux photons. Ces deux photons sont projetés sur la cellule ciblée, au travers d’un laser, afin de faire réagir une molécule de cette cellule, la rendant visible par fluorescence. Le fonctionnement d’une cellule saine est déterminé par l’activité des molécules en son sein. Les observer et caractériser leur temps de vie de fluorescence avec plus de précision, nous permet d’en identifier leur signature moléculaire ainsi que leur fonctionnement normal, et, par la suite, d’en établir un diagnostic.
Il est primordial d’observer l’activité métabolique cellulaire en temps réel avec une résolution subcellulaire, pour comprendre les mécanismes et les processus physiologiques fondamentaux comme ceux de plusieurs pathologies. Pour se faire, il est courant de « taguer » des molécules avec des marqueurs de fluorescence, mais cela nécessite une technique invasive, car on doit « rentrer » dans la cellule. Or, une technique invasive aura toujours, même si très minime, un impact sur l’organisme observé. Mais Chiara Stringari, elle, exploite les molécules fluorescentes déjà présentes dans les cellules — notamment NADH et FAD présentes dans toutes nos cellules vivantes et donnant une information sur le métabolisme — de façon à pouvoir les stimuler, sans pour autant les intégrer artificiellement et interférer avec le système vivant. Cette technique n’en est encore qu’à sa phase préclinique. Les tests sur humain n’ont donc pas encore débuté, les expériences se limitent encore au stade in vitro (sur des organismes artificiels) et in vivo (en particulier sur le poisson-zèbre et la souris).
Observer la molécule, sans la « taguer »
Passer outre l’étape du « tag » rend donc cette technique en développement aussi innovante qu’utile. « C’est le cœur de mes recherches, insiste Chiara Stringari, développer de nouvelles méthodes, utilisant l’optique non linéaire, nous donnant accès à des informations nouvelles, tout en utilisant des contrastes ou des biomarqueurs endogènes — provoquant un contraste suffisant, pour rendre l’utilité de taguer obsolète —, de façon à ce que cette technique soit la moins invasive possible. » La possibilité d’observer l’activité des molécules, comme celle de toutes autres cellules de notre organisme, au plus près, nous permet ainsi de comprendre leur développement, sans porter potentiellement atteinte aux systèmes biologique observés.
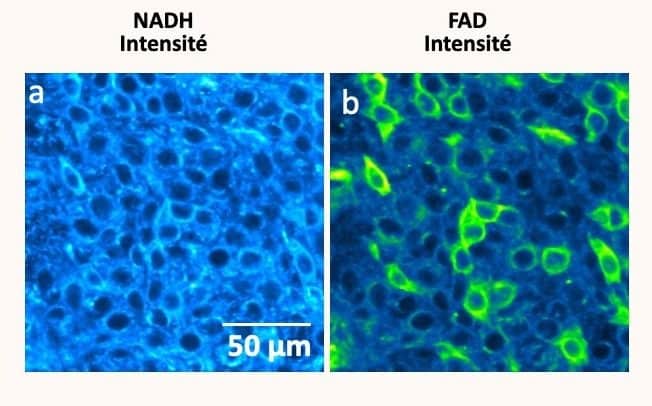
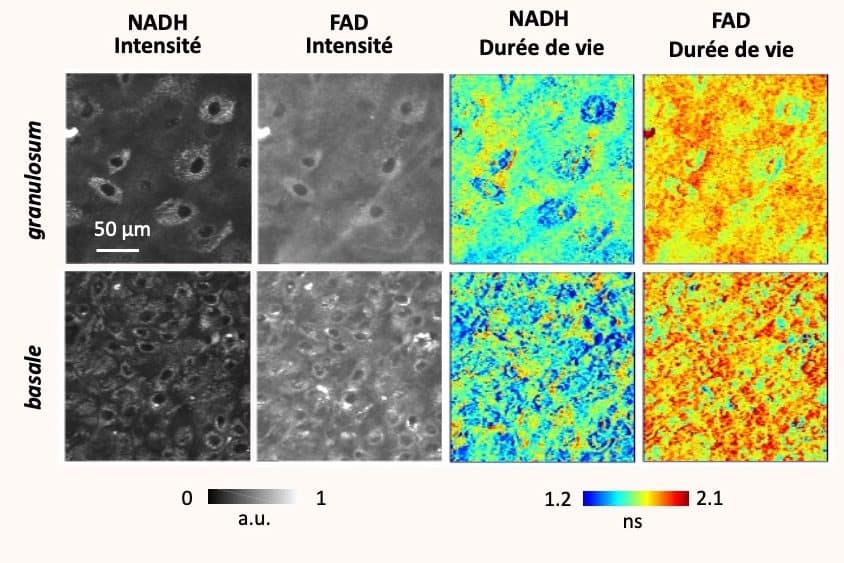
Acquérir ce type de connaissance ouvre la voie à de nombreuses applications en médecine, car cela permet de cartographier le métabolisme des cellules — indicateur de leur activité. « D’autant que le métabolisme, qui est très important pour le développement, agit sur l’épigénétique, précise-t-elle. Le cartographier nous permet d’en faire un modèle, et de mieux comprendre l’intérêt et le rôle des différentes connexions entre cellules. Et donc d’en comprendre les interactions qu’elles ont avec leur environnement. » Cela, par ailleurs, permet l’identification du métabolisme des cellules cancéreuses, susceptibles de développer de nombreuses formes de cancers. « Les biomarqueurs utilisés ont permis de dissocier les cellules saines des cellules cancéreuses. Nous permettant ensuite d’établir des sous-types de métabolismes phénotypiques de cancer. »
« Mieux comprendre le fonctionnement de nos cellules cérébrales »
« L’objectif n’étant pas le diagnostic, cette technique lui apporte, pour autant, de nombreux outils pour le faciliter. Mais selon moi, le plus important reste de mieux comprendre le fonctionnement de nos cellules cérébrales. »
Ces observations nous donnent des informations relatives à l’environnement des molécules. Ce qui permet de comprendre comment elles interagissent avec celui-ci, et comment il les active. Les chercheurs font une mesure expérimentale à une échelle subcellulaire (< 1 µm), afin d’en établir une carte du métabolisme et d’identifier le manque ou l’abondance de certaines molécules dans nos cellules. D’autant que « chaque cellule a comme une sorte d’empreinte digitale de son métabolisme. »
À l’aide d’une autre technique sans marquage — celle de la génération de troisième harmonique, complémentaire à celle de fluorescence à deux photons —, Chiara Stringari travaille notamment sur l’imagerie de la myéline, une gaine lipidique entourant les neurones, qui est « très importante dans la connexion et le support métabolique des neurones, nous précise-t-elle. Étudier une représentation 3D de myélines permet la compréhension de l’impact que sa dégradation peut avoir sur le métabolisme des neurones, en combinaison avec les données obtenues à l’aide de la technique à deux photons. Ce qui nous permet d’en apprendre plus sur notre cerveau, tout en donnant des pistes pour la recherche dans le diagnostic, les deux restant très complémentaires. »
La sclérose en plaques est une maladie portant atteinte à la myéline, provoquant sa dégradation (démyélinisation) et une neurodégénérescence. Un travail de recherche sur cette maladie, en condition ex vivo, a donc été entrepris par Chiara Stringari et son équipe, dans l’optique d’établir « les conséquences biologiques de la pathologie de la myéline au niveau du métabolisme cellulaire et à celui des réseaux de neurones. » Comparer le fonctionnement de phases distinctes, la myélinisation et la démyélinisation, permet d’en apprendre plus sur son fonctionnement, son activité cellulaire, et surtout sa réparation.
En effet, nombreuses sont les maladies provoquées par la dégradation de cellules cérébrales, ce sont les maladies neurodégénératives. Les études entreprises par la chercheuse pourront aider dans l’identification de stratégies thérapeutiques efficaces. Et cela permettra d’aller encore plus loin, en comprenant comment une cellule enclenche sa dégradation, nous pourrions, peut-être un jour, empêcher ce processus.