Il existe des insectes éphémères dont les femelles émergent, s’accouplent, pondent leurs œufs et meurent sous les 5 minutes qui suivent. De l’autre côté du spectre de la longévité, on estime la durée de vie des requins nageant dans les eaux glaciaires du Groenland à environ 400 ans. La diversité des espérances de vie dans la nature est aussi incroyable que l’étendue des tailles, formes, régimes et styles de vie observables chez les êtres vivants. Qu’est-ce que les animaux peuvent donc nous apprendre sur notre propre vieillissement ?
1. Les vers de terre
Avec son millimètre de long, et sa transparence quasi-parfaite, il faudra sûrement être muni d’un microscope, et un peu d’aide, pour repérer le C. elegans — nom scientifique donné à un modeste ver nématode, devenu l’un des piliers de la recherche sur le vieillissement. Ces nématodes ont été découverts par le scientifique Sydney Brenner dans son compost1 en cherchant un nouveau « modèle d’organisme » — une créature qui partage suffisamment de caractéristiques biologiques avec des animaux plus complexes, comme l’humain, mais qui est plus facile à étudier en laboratoire, nous permettant de mieux comprendre comment nous fonctionnons.
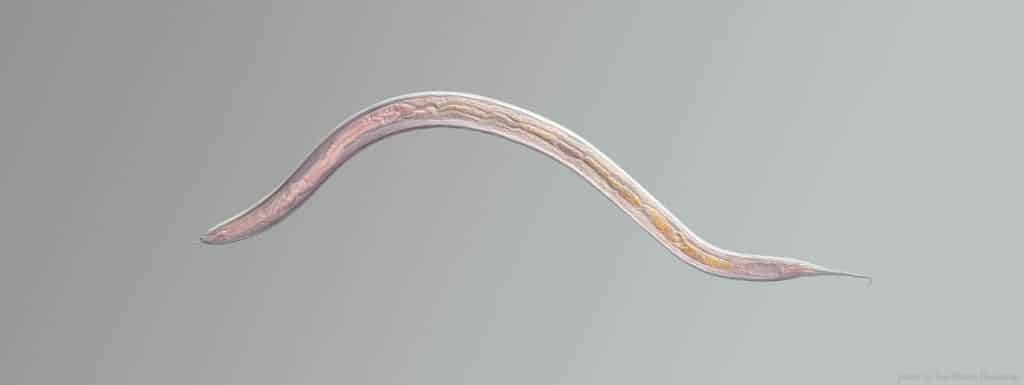
Le ver nous apporte de nombreux avantages concernant les recherches sur la longévité : sa petite taille permet d’en cultiver des centaines dans une boîte de Pétri et son espérance de vie naturelle, ne dépassant pas les deux semaines, donne la possibilité de faire des expériences détaillées en quelques mois, là où les conclusions devraient prendre des années, voire des décennies, pour des animaux à la durée de vie plus longue.
Parmi ses nombreuses contributions à la recherche en biologie, la plus remarquable qu’il nous ait apprise est qu’il suffit de modifier un seul gène pour étendre drastiquement la durée de vie d’une espèce. Le premier « gène de longévité » du ver a été découvert à la fin des années 1980, et a permis, à cette époque, d’augmenter d’environ 50 % la durée de vie de ce dernier2 — cependant, l’idée que l’altération d’un seul gène pouvait étendre l’espérance de vie d’une créature en ayant plus de 20 000 était tellement excentrique, qu’elle n’a su attirer suffisamment d’attention sur elle. Peu d’années après, un autre gène a été découvert, et celui-ci permettait de doubler la durée de vie du ver — passant de deux semaines à quatre3. Ce résultat étant encore plus surprenant – d’autant qu’il a été fait sur un gène totalement différent – a poussé les scientifiques à reconsidérer cette folle idée.
Aujourd’hui, il y a un énorme catalogue de gènes pouvant augmenter l’espérance de vie : le C. elegans en a plus de 600, et il en existe des centaines supplémentaires dans d’autres organismes4. Par exemple, la souris ayant vécu le plus longtemps n’avait pas de régime parfait, ni de programme d’exercices spécifique, ou de médicaments miracles — la « souris de Laron » avait une seule mutation sur un gène lié à l’hormone de croissance, une mutation qui a permis à cette championne de la longévité de mourir à une semaine de son cinquième anniversaire, alors que les souris « normales » vivent rarement au-dessus des trois ans5.
2. Les opossums
Finalement, pourquoi les vers vivent-ils seulement 14 jours, et les souris quelques années, alors que les requins du Groenland, eux, peuvent vivre plus de 400 ans ? C’est vrai, pourquoi les créatures grandissent à en devenir faibles, pour en mourir ensuite ? L’évolution est bien souvent résumée à « la survie du plus fort » — alors pourquoi nous permet-elle de vieillir jusqu’à mourir ? L’opossum, un marsupial américain qui ressemble à une souris de la taille d’un chat, a fourni une indication fortuite sur la manière dont cela peut se produire dans la nature.
L’écologiste Steve Austad a commencé à étudier ces créatures lorsqu’elles se sont égarées dans des pièges placés par un de ses collègues, prévus pour des renards tropicaux. Il décide de profiter de ces prises involontaires pour les équiper de colliers émetteurs. C’est en continuant à les étudier qu’il a constaté quelque chose de remarquable : la vitesse incroyable à laquelle ils vieillissaient. Les animaux passaient d’adultes pleinement fonctionnels à décrépits ou décédés en quelques mois.
Pourquoi les opossums perdent-ils si rapidement la forme ? La réponse, malheureusement pour eux, est qu’ils sont délicieux. Imaginez la vie du point de vue d’un de ces opossums : en tant que souris docile de la taille d’un chat, vous feriez un excellent casse-croûte pour un prédateur (comme ces renards tropicaux que le collègue d’Austad essayait d’attraper). Par conséquent, plus de la moitié des opossums sauvages trouvent la mort entre les griffes (ou les serres) d’une autre créature. Si les opossums vieillissent avec une telle vitesse, c’est en raison d’un compromis évolutif6 : il est inutile de rester en forme et en bonne santé jusqu’à l’âge de 10 ans, si l’on est presque sûr d’être mangé au cours des trois ou quatre premières années. Au lieu de cela, l’évolution concentre l’énergie de l’opossum pour qu’il ait beaucoup de bébés avant que les prédateurs ne le dévorent, sans se préoccuper de l’effondrement de son corps s’il parvient à éviter son malheureux destin.
Ainsi, selon la théorie d’Austad, s’il pouvait trouver une population d’opossums dans un endroit sans prédateurs, l’évolution pourrait adopter une approche différente : grandir et vieillir à un rythme plus lent, sans se précipiter pour littéralement et métaphoriquement dépasser les prédateurs en ayant des enfants aussi vite que possible. Il a effectivement trouvé un tel endroit : l’île de Sapelo, juste au nord de la Floride, qui, après s’être séparée du continent américain il y a 4 000 ans, a perdu ses grands carnivores. 4 000 ans, c’est peut-être long pour l’homme, mais c’est assez court pour que l’on puisse observer la sélection naturelle en action.

Ce qu’il a découvert sur Sapelo, c’est une population d’opossums intrépides : contrairement à leurs homologues du continent qui étaient nerveux et nocturnes, eux se promenaient à la vue de tous, en plein jour. Et, alors que les opossums du continent avaient une durée de vie maximale de 2,5 ans, les versions intrépides de Sapelo pouvaient vivre près de quatre ans7. Au cours de quelques milliers de générations d’opossums, une élégante expérience naturelle nous a montré pourquoi nous vieillissons : l’évolution n’investit pas les ressources nécessaires pour maintenir une espèce en vie, si elle risque de toute façon de mourir d’une autre cause.
3. Les baleines
Si le fait de s’installer sur une île sans prédateurs et d’élever progressivement des humains plus âgés pendant des milliers d’années ressemble à un roman de science-fiction dystopique, la leçon tirée des opossums peut nous mener à quelque chose de plus réalisable. Si vous voulez trouver des animaux qui vivent vraiment longtemps, trouvez ceux qui sont peu exposés aux prédateurs — et peut-être que nous pourrions apprendre quelque chose sur la longévité au travers de leur biologie.
La baleine boréale en est un bon exemple. Avec ses 100 tonnes, elle fait partie des plus grands animaux ayant jamais vécu et, par conséquent, elle est très rarement mangée — quelques rapports font état de groupes d’orques attaquant des baleines boréales, mais leur principale menace reste l’industrie de la chasse à la baleine, qui, heureusement, appartient maintenant en grande partie au passé. En conséquence, ces géants des océans ont acquis l’une des durées de vie les plus longues de la nature — on estime que la plus vieille baleine jamais enregistrée avait 211 ans8.
Des animaux d’une telle grandeur qu’ils n’en sont presque pas comestibles, dotés d’une durée de vie incroyable, correspondent précisément aux attentes de l’évolution, mais présentent un certain paradoxe lorsqu’on les considère à l’échelle cellulaire. La taille d’une cellule reste plus ou moins constante, qu’il s’agisse d’un être humain, d’une souris ou d’une baleine de 100 tonnes, ce qui signifie qu’une baleine boréale possède environ 1000 fois plus de cellules qu’une personne, et celles-ci vivent au moins deux fois plus longtemps. L’énigme qui en découle est simple : pourquoi les baleines boréales ne sont-elles pas toutes atteintes d’un cancer ?
Le cancer est causé par des erreurs aléatoires apparaissant dans le code génétique d’une cellule. C’est l’une des raisons pour lesquelles le cancer est une maladie du vieillissement : plus on vit longtemps, plus ces erreurs génétiques ont le temps de proliférer. Cela signifie également que chaque cellule présente un risque ; le fait d’en avoir 1000 fois plus devrait augmenter considérablement les « chances » d’en développer un. Et pourtant, les baleines ne semblent pas être des géantes tumeurs nageuses. Quel est leur secret ? Une suggestion a été faite en fouillant dans le code génétique de la baleine boréale : elle possède des copies supplémentaires et des variations subtiles des gènes responsables de la réparation de l’ADN9, ce qui signifie peut-être que ses cellules sont plus vigilantes aux mutations qui pourraient donner lieu à un cancer.
En plus d’être résistantes au cancer, les baleines boréales ne semblent pas non plus souffrir de cataractes, l’opacification du cristallin qui affecte de nombreux animaux (y compris les humains) à mesure que nous vieillissons, peut-être en raison des substances chimiques antioxydantes présentes dans leurs lentilles10. Pour arriver à des âges aussi incroyables, les baleines doivent esquiver, ou retarder, toutes les principales maladies qui nous rendent la vie misérable bien avant d’atteindre les 200 ans. La baleine est un animal difficile à étudier en laboratoire, mais leur biologie recèle très certainement quelques astuces de longévité que nous ferions bien d’aller chercher.








